Ведущие эксперты России в оформлении
регистрационных удостоверений!
регистрационных удостоверений!
Москва
Нижний Новгород
Ростов на Дону
Самара
Санкт-Петербург
Екатеринбург
Уфа
Пермь
Новосибирск
Красноярск
Челябинск
Омск
Москва
Санкт-Петербург
Нижний Новгород
Ростов-на-Дону
Самара
Екатеринбург
Уфа
Пермь
Новосибирск
Красноярск
Челябинск
Омск
Москва
Санкт-Петербург
Нижний Новгород
Ростов-на-Дону
Самара
Екатеринбург
Уфа
Пермь
Новосибирск
Красноярск
Челябинск
Омск
Государственная регистрация медицинских изделий в рамках национальной регистрации и регистрации ЕАЭС
Регистрация медицинских изделий

Процедура регистрации медицинских изделий в России: от начала до конца
Регистрация медицинских изделий (МИ) — это обязательная процедура, которая обеспечивает выход продукции на рынок России, гарантируя её безопасность и эффективность. Данный процесс может показаться сложным, особенно для тех, кто сталкивается с этим впервые. В этой статье мы подробно опишем этапы регистрации, чтобы вы могли понять, как этот процесс работает и какие шаги предстоит пройти.
1. Предварительная подготовка
Регистрация начинается с оценки готовности изделия к процессу регистрации. На этом этапе важно определить, подлежит ли изделие обязательной регистрации в России и какой класс риска ему присваивается. Класс риска определяется в зависимости от потенциального воздействия изделия на здоровье пациента. Классификация МИ варьируется от 1 (низкий риск) до 3 (высокий риск).
Также на этапе подготовки проводится анализ технической документации и определение необходимых испытаний. Если ваше изделие производится за границей, вам понадобится уполномоченный представитель в России, который будет представлять ваши интересы перед регуляторными органами.
2. Подготовка регистрационного досье
Регистрационное досье — это основа успешной регистрации. Оно включает в себя все необходимые документы, подтверждающие качество, безопасность и эффективность медицинского изделия. В досье входят техническая документация, данные о клинических испытаниях, спецификации, инструкции по применению, сертификаты соответствия, а также протоколы проведения испытаний.
Важно учесть, что для каждого вида изделия могут требоваться разные наборы документов, и все они должны соответствовать действующим ГОСТам и требованиям Росздравнадзора.
3. Проведение испытаний
Испытания медицинских изделий включают в себя технические и токсикологические испытания, а также клиническую оценку.
4. Подача документов в Росздравнадзор
После завершения всех испытаний и подготовки досье, оно подаётся в Росздравнадзор. На этом этапе регулятор рассматривает предоставленные документы и проверяет их соответствие требованиям. Важно, чтобы все документы были правильно оформлены и содержали актуальные данные, поскольку ошибки могут привести к задержке регистрации. Подача документов осуществляется через официальный портал Росздравнадзора: roszdravnadzor.gov.ru.
5. Экспертиза безопасности, качества и эффективности
Экспертиза медицинского изделия — это один из самых сложных этапов процесса регистрации. Росздравнадзор проводит тщательную проверку всех представленных материалов, чтобы убедиться, что изделие соответствует установленным требованиям безопасности, качества и эффективности. В ходе экспертизы оцениваются данные о конструктивных особенностях, материалы, результаты технических и клинических испытаний, а также соответствие продукции нормативным документам.
Экспертиза может включать несколько раундов уточнений и доработок, поскольку любая неточность или несоответствие в документации может привести к запросам дополнительных данных. Важно учитывать, что экспертные учреждения и Росздравнадзор строго следуют нормативным требованиям, и даже небольшие ошибки могут затянуть процесс регистрации.
6. Получение регистрационного удостоверения
После успешного завершения экспертизы и рассмотрения документов выдается Регистрационное удостоверение (РУ), которое подтверждает, что медицинское изделие соответствует всем требованиям безопасности и качества, установленным в России. Существует два типа регистрационных удостоверений:
7. Пострегистрационные обязательства
Получение регистрационного удостоверения не означает завершение работы. Необходимо обеспечить пострегистрационный надзор за изделием, чтобы убедиться, что оно продолжает соответствовать требованиям безопасности и качества в процессе эксплуатации. Также следует проводить периодическое обновление документации и вносить изменения в случае модификаций изделия. Пострегистрационный надзор включает в себя мониторинг побочных эффектов, выявление дефектов и их своевременное устранение.
Заключение
Регистрация медицинских изделий — это многоэтапный процесс, требующий глубокого понимания нормативных требований, тщательной подготовки документации и прохождения различных испытаний. Он может показаться сложным и долгим, особенно для новичков в этой области. Однако правильный подход и помощь опытных специалистов позволяют минимизировать риски и ускорить получение регистрационного удостоверения.
Если вам нужен партнёр, который возьмёт на себя весь процесс регистрации — от подготовки документации до взаимодействия с Росздравнадзором — наша компания готова помочь. Мы обладаем необходимым опытом и знаниями, чтобы сделать этот процесс максимально прозрачным и эффективным для вас.
Полезные ссылки
Регистрация медицинских изделий (МИ) — это обязательная процедура, которая обеспечивает выход продукции на рынок России, гарантируя её безопасность и эффективность. Данный процесс может показаться сложным, особенно для тех, кто сталкивается с этим впервые. В этой статье мы подробно опишем этапы регистрации, чтобы вы могли понять, как этот процесс работает и какие шаги предстоит пройти.
1. Предварительная подготовка
Регистрация начинается с оценки готовности изделия к процессу регистрации. На этом этапе важно определить, подлежит ли изделие обязательной регистрации в России и какой класс риска ему присваивается. Класс риска определяется в зависимости от потенциального воздействия изделия на здоровье пациента. Классификация МИ варьируется от 1 (низкий риск) до 3 (высокий риск).
Также на этапе подготовки проводится анализ технической документации и определение необходимых испытаний. Если ваше изделие производится за границей, вам понадобится уполномоченный представитель в России, который будет представлять ваши интересы перед регуляторными органами.
2. Подготовка регистрационного досье
Регистрационное досье — это основа успешной регистрации. Оно включает в себя все необходимые документы, подтверждающие качество, безопасность и эффективность медицинского изделия. В досье входят техническая документация, данные о клинических испытаниях, спецификации, инструкции по применению, сертификаты соответствия, а также протоколы проведения испытаний.
Важно учесть, что для каждого вида изделия могут требоваться разные наборы документов, и все они должны соответствовать действующим ГОСТам и требованиям Росздравнадзора.
3. Проведение испытаний
Испытания медицинских изделий включают в себя технические и токсикологические испытания, а также клиническую оценку.
- Технические испытания позволяют убедиться, что изделие соответствует установленным стандартам качества и безопасности.
- Токсикологические испытания проверяют отсутствие вредных воздействий материалов, из которых изготовлено изделие.
- Клинические испытания требуются для подтверждения эффективности изделия и его безопасности при использовании по назначению.
4. Подача документов в Росздравнадзор
После завершения всех испытаний и подготовки досье, оно подаётся в Росздравнадзор. На этом этапе регулятор рассматривает предоставленные документы и проверяет их соответствие требованиям. Важно, чтобы все документы были правильно оформлены и содержали актуальные данные, поскольку ошибки могут привести к задержке регистрации. Подача документов осуществляется через официальный портал Росздравнадзора: roszdravnadzor.gov.ru.
5. Экспертиза безопасности, качества и эффективности
Экспертиза медицинского изделия — это один из самых сложных этапов процесса регистрации. Росздравнадзор проводит тщательную проверку всех представленных материалов, чтобы убедиться, что изделие соответствует установленным требованиям безопасности, качества и эффективности. В ходе экспертизы оцениваются данные о конструктивных особенностях, материалы, результаты технических и клинических испытаний, а также соответствие продукции нормативным документам.
Экспертиза может включать несколько раундов уточнений и доработок, поскольку любая неточность или несоответствие в документации может привести к запросам дополнительных данных. Важно учитывать, что экспертные учреждения и Росздравнадзор строго следуют нормативным требованиям, и даже небольшие ошибки могут затянуть процесс регистрации.
6. Получение регистрационного удостоверения
После успешного завершения экспертизы и рассмотрения документов выдается Регистрационное удостоверение (РУ), которое подтверждает, что медицинское изделие соответствует всем требованиям безопасности и качества, установленным в России. Существует два типа регистрационных удостоверений:
- Регистрационное удостоверение для Российской Федерации — позволяет реализовывать изделие только на территории России.
- Регистрационное удостоверение для зарубежных изделий — выдаётся для продукции, произведённой за пределами России, и позволяет её ввоз и обращение на территории РФ.
7. Пострегистрационные обязательства
Получение регистрационного удостоверения не означает завершение работы. Необходимо обеспечить пострегистрационный надзор за изделием, чтобы убедиться, что оно продолжает соответствовать требованиям безопасности и качества в процессе эксплуатации. Также следует проводить периодическое обновление документации и вносить изменения в случае модификаций изделия. Пострегистрационный надзор включает в себя мониторинг побочных эффектов, выявление дефектов и их своевременное устранение.
Заключение
Регистрация медицинских изделий — это многоэтапный процесс, требующий глубокого понимания нормативных требований, тщательной подготовки документации и прохождения различных испытаний. Он может показаться сложным и долгим, особенно для новичков в этой области. Однако правильный подход и помощь опытных специалистов позволяют минимизировать риски и ускорить получение регистрационного удостоверения.
Если вам нужен партнёр, который возьмёт на себя весь процесс регистрации — от подготовки документации до взаимодействия с Росздравнадзором — наша компания готова помочь. Мы обладаем необходимым опытом и знаниями, чтобы сделать этот процесс максимально прозрачным и эффективным для вас.
Полезные ссылки
- Официальный сайт Росздравнадзора: roszdravnadzor.gov.ru
- Государственный реестр медицинских изделий: Государственный реестр МИ
- Постановление Правительства РФ от 27.12.2012 № 1416: base.garant.ru
Медицинские изделия
Медицинские изделия: регистрация и необходимые процедуры
Регистрация медицинских изделий — это обязательная процедура, обеспечивающая легальное обращение любой продукции медицинского назначения, как отечественного, так и иностранного производства, на территории Российской Федерации. Ранее медицинские изделия назывались изделиями медицинского назначения или изделиями медицинской техники. В процессе регистрации охватываются самые разные категории продукции, включая:
Регистрация медицинских изделий — это обязательная процедура, обеспечивающая легальное обращение любой продукции медицинского назначения, как отечественного, так и иностранного производства, на территории Российской Федерации. Ранее медицинские изделия назывались изделиями медицинского назначения или изделиями медицинской техники. В процессе регистрации охватываются самые разные категории продукции, включая:
- Инструменты медицинские (иглы, скальпели, ножницы, зажимы и др.).
- Изделия протезно-ортопедические (протезы конечностей, бандажи, костыли, ходунки и др.).
- Приборы для функциональной диагностики (эндоскопы, электрокардиографы, тонометры, пульсоксиметры и др.).
- Приборы и аппараты для медицинских лабораторных исследований (анализаторы биохимические, иммунологические и др.).
- Приборы и аппараты для лечения (аппараты ИВЛ, электростимуляторы, лазерные аппараты и др.).
- Оборудование дезинфекционное и стерилизационное (паровые и воздушные автоклавы, утилизаторы медицинских отходов и др.).
- Средства перемещения и перевозки медицинские (носилки, тележки, кровати, кресла-коляски и др.).
Регистрационное удостоверение

Макет регистрационного удостоверения (нового образца)
Регистрационное удостоверение
Регистрационное удостоверение (РУ) — основной документ, подтверждающий легальное использование медицинского изделия на территории РФ. В зависимости от происхождения изделия существуют различные виды РУ:
Регистрационное удостоверение (РУ) — основной документ, подтверждающий легальное использование медицинского изделия на территории РФ. В зависимости от происхождения изделия существуют различные виды РУ:
- Национальная регистрация: проводится в соответствии с Постановлением Правительства РФ от 27.12.2012 № 1416 (ред. от 24.11.2020) "Об утверждении Правил государственной регистрации медицинских изделий" и постановлением № 552 от 01.04.2022.
- Регистрация в рамках ЕАЭС: согласно Решению Совета Евразийской экономической комиссии от 12.02.2016 № 46.
- Регистрация партии: упрощённая регистрация в соответствии с ПП РФ № 430 от 03.04.2020.
- Форма регистрационного удостоверения и информация, которую оно должно содержать, утверждены приказом Росздравнадзора № 40-Пр/13 от 16 января 2013 года.
Какие документы нужны для регистрации медицинского изделия
Пакет документов отличается в зависимости от производителя.
Список документов:
1. Каталог (текущий)
2. Выписка о регистрации производителя
3. Лицензия на производство или бизнес
4. Сертификат ISO 13485
5. Декларация или сертификат соответствия продукции требованиям Директивы 93/42/ЕЭС
6. Технический файл на продукт:
8. Инструкция по применению
9. Анализ рисков и отчет об управлении
10. Отчет или протокол испытаний о стабильности продукта в течение заявленного срока годности (т.е. документы, подтверждающие заявленный срок годности продукта стандарта EN 455-4).
11. Отчет или протокол испытаний о клинической безопасности (клинической эволюции) со статистикой продаж и отметкой о наличии рекламаций, рекламаций от потребителей и т.д.
12. Технологическая схема производства (если она не указана в техническом файле).
13. Информация о зарегистрированных продуктах в других странах (при наличии)
14. Протоколы ЭМС (электромагнитная совместимость) (60601-1-2-2014, 60601-1-2010)
При возникновении вопросов, отправьте нам запрос
Отечественный изготовитель должен предоставить:
- Сертификат ISO 13485
- Договор аренды на производственную площадку между собственником и производством (копия)
- ПРИЕМА ПЕРЕДАЧИ НЕЖИЛОГО ПОМЕЩЕНИЯ (копия)
- Свидетельства о регистрации права на производственную площадку(копия)
- Выписки из ИНН, ОГРН, ЕГРЮЛ
- Акт квалификационных испытаний
- Протокол квалификационных испытаний
- Менеджмент риска
- Спецификации на изделие
- Паспорта безопасности
- Инструкция по применению(ИПП)
- Техническое условие(ТУ)
- Технические испытания
- Токсикологические исследования
- Клинические испытания
- Фотоальбом(фотографические изображение изделия и принадлежностей)
- Доверенность на подачу в РЗН
- Заявление на гос.регистрацию
- Нормативный документ(НД)
- Платежные поручения (за бланк и экспертизу качества)
Для иностранных производителей потребуется:
Список документов:
1. Каталог (текущий)
2. Выписка о регистрации производителя
3. Лицензия на производство или бизнес
4. Сертификат ISO 13485
5. Декларация или сертификат соответствия продукции требованиям Директивы 93/42/ЕЭС
6. Технический файл на продукт:
- Описание изделия, конструкция (чертежи, конструкторская документация)
- Схема производственного процесса
- Состав продукции, материалы, паспорта безопасности сырья.
- Спецификации для медицинских устройств
- Протоколы испытаний для биологической оценки или биосовместимости продуктов (в соответствии с ISO 10993): испытание на раздражение кожи, повышение чувствительности кожи, испытание на цитотоксичность, отчеты об испытаниях на стерильность (при наличии)
8. Инструкция по применению
9. Анализ рисков и отчет об управлении
10. Отчет или протокол испытаний о стабильности продукта в течение заявленного срока годности (т.е. документы, подтверждающие заявленный срок годности продукта стандарта EN 455-4).
11. Отчет или протокол испытаний о клинической безопасности (клинической эволюции) со статистикой продаж и отметкой о наличии рекламаций, рекламаций от потребителей и т.д.
12. Технологическая схема производства (если она не указана в техническом файле).
13. Информация о зарегистрированных продуктах в других странах (при наличии)
14. Протоколы ЭМС (электромагнитная совместимость) (60601-1-2-2014, 60601-1-2010)
При возникновении вопросов, отправьте нам запрос
Наши специалисты проконсультируют вас по полному перечню документов. При отсутствии каких-либо документов и информации по ним, мы самостоятельно разработаем
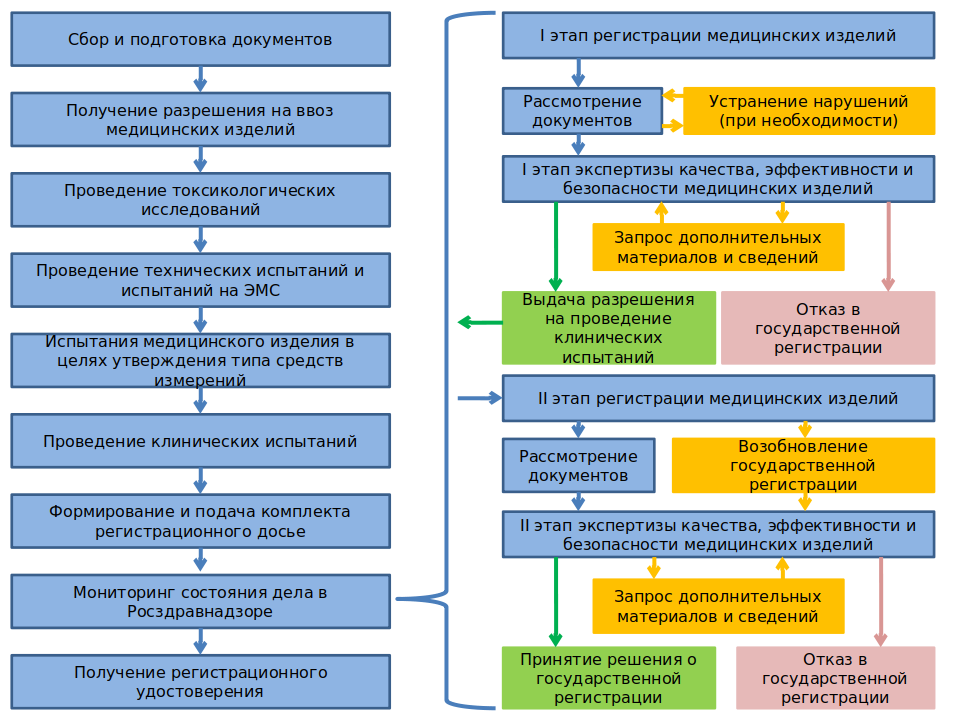
Схема регистрации медицинских изделий
Мы предлагает комплексный набор услуг по регистрации медицинских изделий:
- Консультирование и выбор оптимальной схемы регистрации изделия в зависимости от класса риска применения изделия;
- Подготовка полного комплекта документов представляемого в Федеральную службу по надзору в сфере здравоохранения (Росздравнадзор);
- Проведение технических испытаний, включая безопасность, электро-магнитную совместимость и проверку функциональных характеристик с соответствии с нормативной документацией;
- Проведение испытаний на нетоксичность, апирогенность и стерильность изделий и материалов;
- Проведение клинических (медицинских) испытаний в уполномоченных медицинских учреждениях;
- Разработка/корректировка нормативно-технической документации;
- Разработка/корректировка файла менеджмента рисков в соответствии с требованиями ГОСТ ISO 14971-2011;
- Разработка корректировка файла проектирования с учетом эксплуатационной пригодности по ГОСТ Р МЭК 62366-2013;
- Разработка/корректировка эксплуатационной документации (руководство по эксплуатации, инструкция по применению, паспорт, формуляр и т.д);
- Перевод и нотариальное заверение документов изготовителя;
- Представление интересов заявителя в федеральной службе здравоохранения и социального развития.
Схема прохождение регистрационного досье в Росздравнадзоре и экспертной организации
Цены и сроки офомления
.
1 класс:
Цена: от 330.000 т.р
Срок оформления – от 5 месяцев.
2 класс:
Цена: от 350.000 т.р
Срок оформления – от 6 месяцев.
3 класс:
Цена: от 410.000 т.р
Срок оформления – от 7 месяцев.
В случае, если часть документации на медицинское изделие уже разработана, а некоторые из этапов работ успешно пройдены, то срок и стоимость регистрации можно уменьшить. Для получения точного расчёта стоимости услуг обращайтесь к нам!
Поэтапная оплата услуг!*
* При необходимости можно согласовать индивидуальные условия оплаты.